El equilibrio de fases es el estudio que se encarga de conocer el equilibrio que existe en los diferentes estados de la materia (sólido, líquido y gaseoso). Dicho equilibrio se define como una etapa donde el potencial químico de cualquier componente presente en el sistema permanece estable con el tiempo. Una fase se refiere a la forma de la materia que es uniforme y homogénea química y físicamente.
El equilibrio de fases tiene una amplia gama de aplicaciones en industrias que incluyen la producción de diferentes alótropos de carbono, la reducción del punto de congelación del agua mediante la disolución de sal (salmuera), la purificación de componentes por destilación, el uso de emulsiones en la producción de alimentos, la industria farmacéutica, etc.
Regla de las Fases de Gibbs
Esta regla define las condiciones de equilibrio en términos de las relaciones entre el número de fases y la composición de un sistema, su objetivo es determinar el número mínimo de variables necesarias para describir el estado de equilibrio de un sistema.
f = c - p + 2
Donde:
c: Número de componentes
p: Número de fases
f: Número de grados de libertad (presión, temperatura y composición en sistemas de más de un componente ) que se pueden modificar sin que varíe la fase del sistema.
El número 2 indica que se puede tener a la temperatura y a la presión como variables independientes y el número de grados de libertad es el número de variables que se requieren fijar para definir completamente al sistema.
Por ejemplo, en un sistema donde P = cte. o T = cte. Se tendrá: f = c - p + 1
Presión de Vapor
Es aquella presión en la que con una temperatura determinada, la fase líquida y el vapor se encuentra en equilibrio dinámico; su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. La temperatura a la que esta presión de vapor es igual a una atmósfera (1atm), se denomina temperatura de ebullición.
Los cambios de fase, se presentan cuando se agrega o se quita energía (casi siempre en forma de calor). Son cambios físicos ya que cambian el orden molecular; en la fase sólida las moléculas alcanzan el máximo ordenamiento, y en la fase gaseosa tienen el mayor desorden. Las relaciones completas entre las fases se representan mejor en una sola gráfica conocida como diagrama de fases, el cual resume las condiciones en las cuales una sustancia existe como sólido, líquido o gas. Estas relaciones generalmente se representan como el cambio en la fase de un sistema en función de la temperatura, la presión o la composición de los componentes de un sistema.
Diagrama de fases P en función de T, donde se denotan las fases sólida, líquida y gaseosa, se expresa el punto triple y el punto crítico para sistemas de un solo componente.
Las curvas que se muestran en la figura representan la coexistencia de dos fases. La curva de fusión es la curva en la cual la fase sólida y líquida de un sistema se mantiene en equilibrio. La fase líquida y gaseosa de un sistema permanece en equilibrio a lo largo de la curva de vaporización, mientras que la curva de sublimación representa la etapa de equilibrio entre la fase sólida y la fase gaseosa. El punto triple es el punto en la gráfica donde los tres estados coexisten y es único para cada componente.
Ecuación de Clausius-Clapeyron
La ecuación de Clausius-Clapeyron es aquella que relaciona los cambios en la presión de vapor y la temperatura, en una transición de fase o cambio de estado. Aplica para sublimaciones, evaporaciones, fusiones, o incluso en cambios de fases cristalinas y para una sustancia pura que se encuentra en equilibrio. Esta ecuación deriva de las leyes termodinámicas y de los diagramas P-T para una sustancia, en donde se observa la línea de coexistencia; aquella que separa dos fases distintas. Para traspasar dicha línea, es necesaria la ganancia o pérdida de calor, tal como la entalpía de vaporización, ΔHvap.
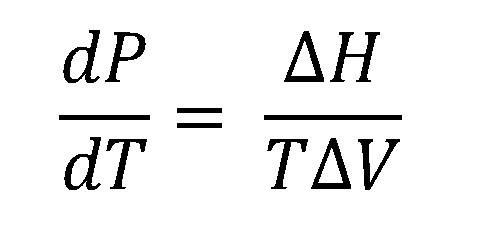
En la imagen superior se muestra la ecuación de Clausius-Clapeyron antes de ser integrada. Normalmente suele aplicarse para sistemas líquido-vapor, donde se usa ΔHvap y se desea calcular cuál será la presión de vapor del líquido a cierta temperatura. Asimismo, sirve para calcular el ΔHvap de un determinado líquido en un rango de temperaturas. también es utilizada con bastante frecuencia para estudiar los cambios de presión en los sólidos volátiles, es decir, se considera la entalpía de sublimación ΔHsub. Asumiendo que el vapor se comporta como un gas ideal e integrando, se obtiene la ecuación de Clausius-Clapeyron integrada:
- Realizado por:
- Aguilera, Francisco
- González, Elizabeth
- Lezama, Arianna
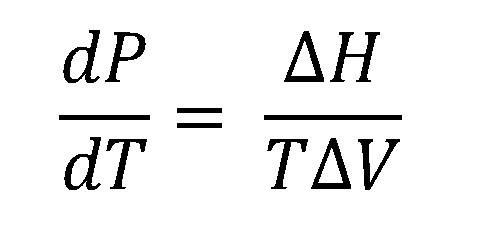
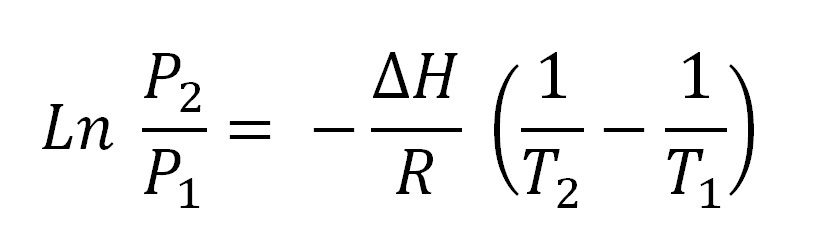
Comentarios
Publicar un comentario