Gases: ideales y reales
Las leyes de los gases y la teoría cinética molecular suponen que las moléculas en estado gaseoso no ejercen fuerza alguna entre ellas, ya sean de atracción o de repulsión. Otra suposición es que el volumen de las moléculas es pequeño, y por tanto despreciable, en comparación con el recipiente que los contiene. Un gas que satisface estas condiciones se dice que tiene un comportamiento ideal.
Para explicar el comportamiento de los gases, se desarrollaron distintas ecuaciones matemáticas empleando herramientas estadísticas. Sin embargo, fue necesario simplificar y modificar estas ecuaciones porque no funcionaban para todos los tipos de gases, por lo que se definieron distintos modelos de gases, gas ideal y gas real.
Un gas ideal es un gas teórico compuesto de partículas que se mueven al azar y que no interactúan entre ellas. Los gases en general se comportan de manera ideal cuando se encuentran a altas temperaturas y bajas presiones. Esto es debido a la disminución de las fuerzas intermoleculares.
Cuando un gas se encuentra a muy baja temperatura y/o bajo condiciones de presión extremadamente altas ya no se comporta de forma ideal. Bajo estas condiciones las leyes de los gases no se cumplen. El gas real es aquel que posee un comportamiento termodinámico y que no sigue la misma ecuación de estado de los gases ideales. Los gases se consideran como reales a presión elevada y poca temperatura. Aunque se puede suponer que los gases reales se comportan como un gas ideal, no se debe esperar que lo hagan en todas las condiciones.
Relaciones Algebraicas
Ecuación de Van der Waals
Johannes D. Van der Waals en 1873 propuso una modificación de la ley de gas ideal, para tener en cuenta el tamaño molecular y las fuerzas de interacción moleculares; se le conoce normalmente como la ecuación de estado de Van der Waals. Las constantes a y b tiene valores positivos y son características del gas individual. La ecuación de estado de Van der Waals, se aproxima a la ley de gas ideal PV=nRT a medida que el valor de estas constantes se acercan a cero. La constante a provee una corrección para las fuerzas intermoleculares y la constante b es una corrección para el tamaño molecular finito y su valor es el volumen de una mol de átomos o moléculas.
Por ejemplo, 1 m3 de aire a 27 °C y 1 atm se comprime hasta un volumen de 5 litros a temperatura constante. Calcular la presión final empleando la ecuación de Van der Waals. Las constantes experimentales de la ecuación de Van der Waals para el aire son:
a=1,33 atm(l/mol)2
b= 0.0366 l/mol
Datos
V1= 1 m3
V2= 5L
T1= 27°C = 300.15 K
T2= 27°C = 300.15 K
P1= 1 atm
P2 = ?
Determinamos el número de moles; como la presión inicial es baja, el número de moles se puede calcular con la ecuación universal de los gases ideales:
Luego calculamos la presión con la ecuación de Van der Waals con las condiciones finales:
Ecuación de Redlich-Kwong
Es una ecuación cúbica de estado propuesta en 1949 como una mejora a la ecuación de Van der Waals, incluyendo un factor dependiente de la temperatura. No es recomendable para fase líquida ni para estimar equilibrio líquido-vapor, sin embargo, se recomienda para calcular propiedades de fase gaseosa cuando el cociente entre la presión y la presión crítica es menor a la mitad del cociente entre la temperatura y la temperatura crítica. Esta ecuación es bastante aproximada a presiones elevadas.
Donde la constante a provee una corrección para las fuerzas intermoleculares y la constante b es una corrección para el tamaño molecular finito y su valor es el volumen de una mol de átomos o moléculas.
Daniel Berthelot mejoró la ecuación de estado de van der Waals desarrollando una ecuación de estado que puede ser considerada como la base de la ecuación de Redlich-Kwong. La ecuación de estado de Berthelot se remonta a 1903 y es una ecuación generalizada de 2 constantes, muy similar a la de van der Waals, con la diferencia que el término que se adiciona a la presión, contiene también la temperatura en el denominador.
Los gases reales se desvían del comportamiento del gas ideal significativamente entre más cercano esté un gas a un cambio de fase, sea menor la temperatura o más grande la presión. Esta desviación puede ser explicada por un factor de corrección llamado el Factor de compresibilidad Z. El Factor de compresibilidad, también conocido como factor de compresión, es una propiedad termodinámica útil para modificar la ley de los gases ideales para ajustarse al comportamiento de un gas real. Este factor viene dado por la razón del volumen molar de un gas con relación al volumen molar de un gas ideal a la misma temperatura y presión.
Z = Pv/RT, también puede ser expresada como → Z=V real/V ideal
Para gases ideales Z=1, pero para gases reales Z puede ser mayor o menor que la unidad, mientras Z esté más lejos de la unidad, más el gas se desvía del comportamiento de los gases ideales. Por ejemplo, si se tiene una muestra de gas a temperatura de 350 K y una presión de 12 atmósferas, con un volumen molar 12 % mayor al predicho por la ley de los gases ideales. Calcular el Factor de compresión Z
Sabiendo que V real es 12 % mayor que V ideal :
V real = 1.12 V ideal
Z = V real/V ideal = 1.12 → Factor de compresibilidad
La ley de los estados correspondientes indica que todos los fluidos, cuando se comparan con la misma temperatura reducida y presión reducida, tienen aproximadamente idéntico factor de compresibilidad y se desvían del comportamiento de gas ideal en, más o menos, el mismo grado, de igual forma dos gases a la misma temperatura reducida y bajo la misma presión reducida. Esta ley señala que conociendo un número determinado de propiedades termodinámicas (Presión, Temperatura o Volumen) existe un solo valor para la siguiente propiedad. Viene expresada por la regla de las fases que dice:
L = N - F + 2
Donde:
L= Número de grados de libertad.
N= Número de Componentes
F= Número de Fases
Por ejemplo, si se tiene agua a presión y temperatura ambiente (1 atm y 25°C), entonces:
N = 1 (Sólo hay agua)
F = 1 (Es en estado líquido)
entonces si se sustituye
L = 1 + 1 - 2
L = 0
Cuando L es igual a cero, quiere decir que el sistema se encuentra totalmente determinado, es decir, ya no faltan datos para saber su estado, y solo existe un valor para su volumen. Otro ejemplo es, si se está calentando en una olla para la cocina y está tapada. Supongamos que la olla está a 90°C y con un volumen de 3 L, si la llenas mitad aire y mitad agua, sería así:
N = 2 (Agua y Aire)
F = 2 (Líquido del agua y Vapor del agua junto con el gas)
L = 2 - 2 + 2
L = 2
Quiere decir que se necesitan por lo menos otras 2 propiedades para definir todo el sistema. Estas otras dos variables pueden ser la composición de agua y aire para obtener la presión.
- Realizado por:
- Aguilera, Francisco
- González, Elizabeth
- Lezama, Arianna

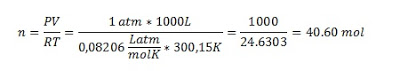

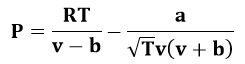
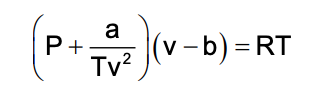
Comentarios
Publicar un comentario