Teoría Cinético-Molecular
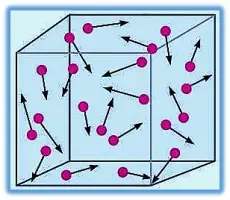
Existe una teoría basada en la idea de que la materia está formada por pequeñas partículas que se encuentran en constante movimiento y entre las cuales se encuentra un vacío; este fundamento se conoce como la Teoría Cinético Molecular. Los descubrimientos de Maxwell, Boltzmann y otros, originaron muchas generalizaciones sobre cómo actúan los gases, los cuales se conoce desde entonces como la teoría cinético molecular de los gases, o simplemente la teoría cinética de los gases.
Esta teoría presenta 4 postulados esenciales, los cuales son:
- Un gas está compuesto de moléculas que están separadas por distancias mucho mayores que sus propias dimensiones. Las moléculas poseen masa pero tienen un volumen insignificante.
- Las moléculas de los gases están en continuo movimiento en dirección aleatoria y con frecuencia chocan unas contra otras. Las colisiones entre las moléculas son perfectamente elásticas, es decir, la energía se transfiere de una molécula a otra por efecto de las colisiones. Sin embargo, la energía total de todas las moléculas en un sistema permanece inalterada.
- Las moléculas de los gases no ejercen entre sí fuerzas de atracción o de repulsión.
- La energía cinética promedio de las moléculas es proporcional a la temperatura del gas en kelvin. Dos gases a la misma temperatura tendrán la misma energía cinética promedio.
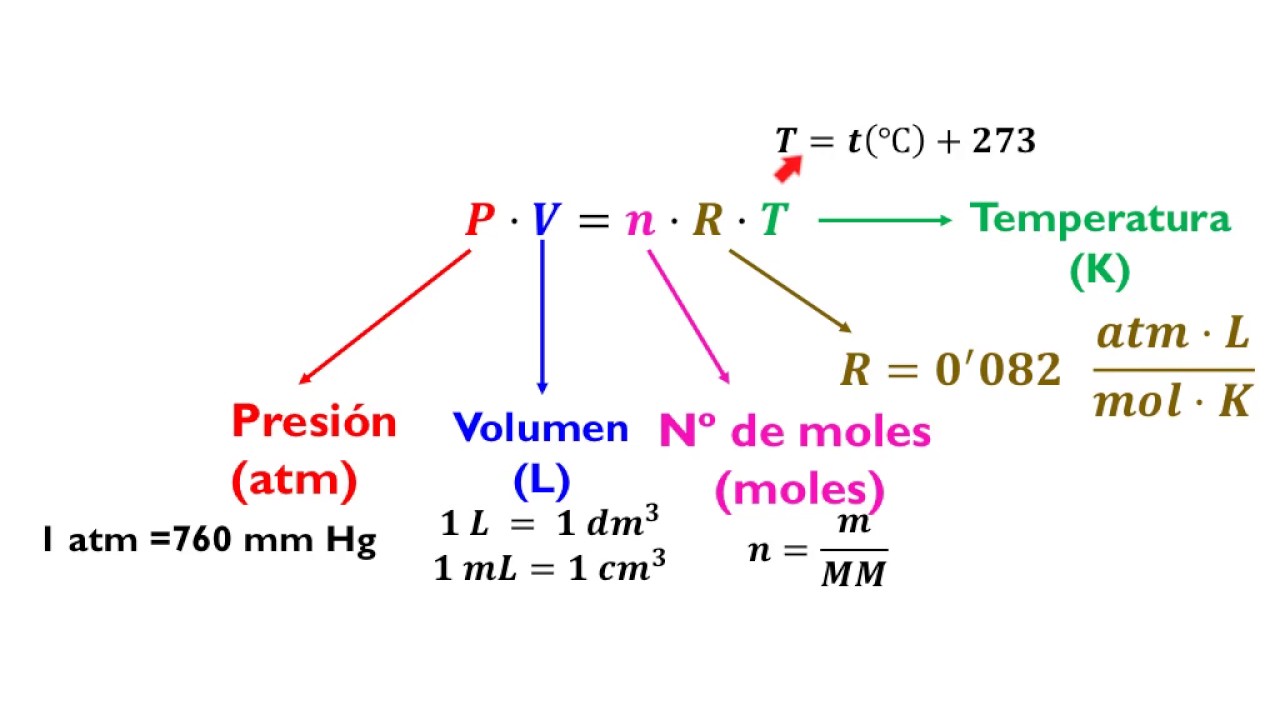
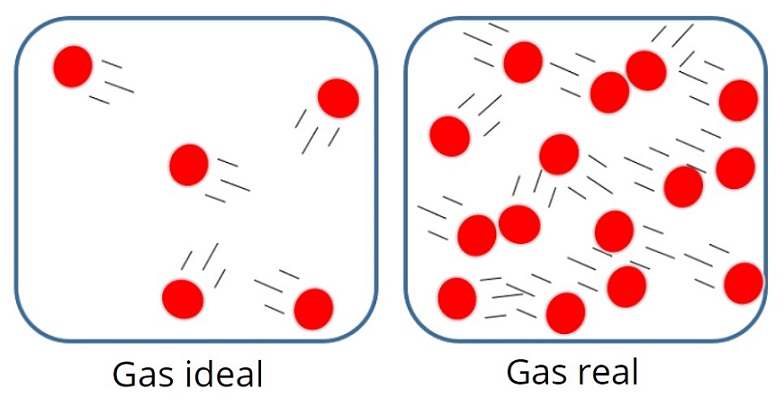
Podemos definir a un gas ideal como un gas (valga la redundancia) hipotético, teórico o ficticio. En este fenómeno las distintas partículas en movimiento que lo componen, actúan de manera independiente sin influenciar el comportamiento de todas las demás. Es común que surja la pregunta de ¿por qué posee tanta relevancia un concepto que carece de validez real? y es que, muchos de los gases reales conocidos se comportan a temperatura y presión ambientales como un gas ideal, al menos desde una perspectiva cuantitativa, lo cual permite que estos puedan ser tratados como gases ideales dentro de parámetros razonables, facilitando en gran medida los cálculos a realizar. La ecuación del gas ideal se aplica a los sistemas que no experimentan cambios en presión, volumen, temperatura y cantidad de un gas. Combinando las expresiones de las leyes de los gases, es decir, la Ley de Boyle, la Ley de Charles y la Ley de Avogadro, logramos obtener la ecuación del gas ideal: PV=nRT, donde R representa la constante universal de los gases (R=0.0821 L·atm/K·mol).
Para que un gas pueda ser considerado ideal, sus moléculas no deben colapsar entre ellas ni manifestar fuerzas de atracción y repulsión. Cuando el gas no cumple con estas condiciones, desviándose del comportamiento ideal, se denominan gases reales y solo cumplen con la ecuación del gas bajo condiciones determinadas de presión y temperatura. Estas condiciones se titulan como temperatura y presión estándar, que habitualmente se abrevian TPE, utilizando así una temperatura a 0°C (273.15 K) y 1 atm de presión, donde dichos gases reales se comportan como un gas ideal.

Comentarios
Publicar un comentario