Balance de Masa
Principio de Conservación de la Materia (Balance de Materia)
La Ley de la Conservación de la Materia, es también llamada Ley de conservación de la masa o Ley de Lomonósov-Lavoisie, donde postula que la materia no se crea ni se destruye durante una reacción química, solo se transforma. Esto significa que las cantidades de las masas involucradas en una reacción determinada deberán ser constantes, es decir, la cantidad de reactivos consumidos es igual a la cantidad de productos formados, aunque se hayan transformado los unos en los otros. Es una de las leyes fundamentales en todas las ciencias naturales. Esta ley es bastante precisa para procesos de baja energía, como es el caso de las reacciones químicas. En el caso de reacciones nucleares o colisiones entre partículas en altas energías, en las que la definición clásica de masa no aplica, hay que tener en cuenta la equivalencia entre masa y energía.
Análisis de problemas de Balance de materia
- Interpretar adecuadamente el enunciado del problema: Conviene leer el problema varias veces para comprenderlo y asimilarlo bien. Tratar de identificar qué datos son conocidos y cuáles desconocidos. Si existe una o más reacciones químicas involucradas o por el contrario no hay ninguna. Si se conocen bien todas y cada una de las sustancias químicas que intervienen (elementos químicos y fórmulas de las moléculas) y que cambios pueden sufrir en las condiciones a que van a ser sometidas.
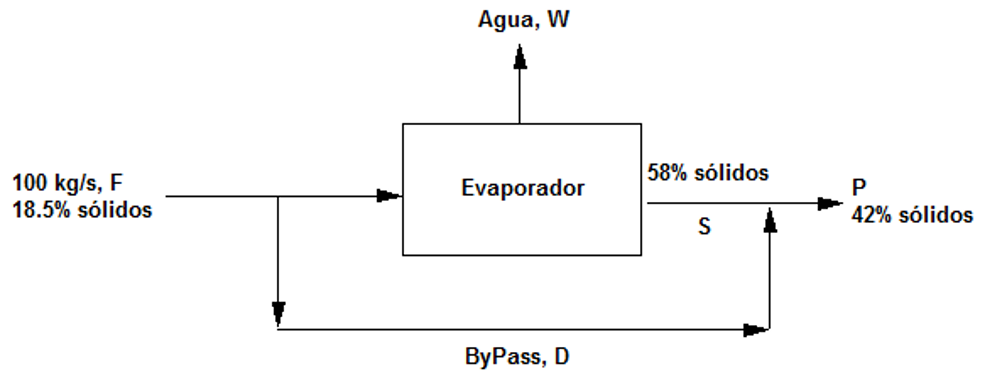
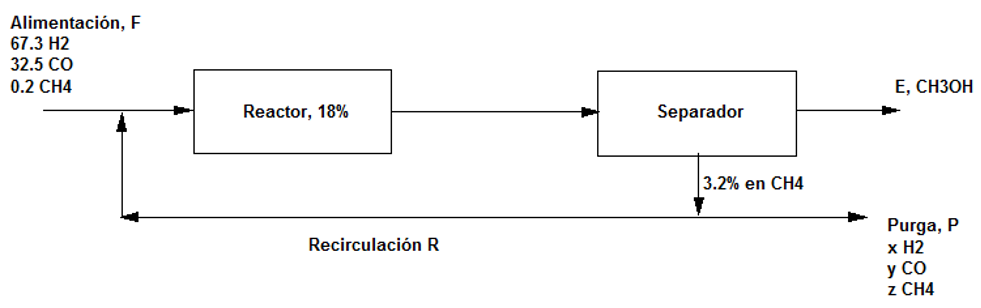
- Dibujar un diagrama de flujo: En el que se representen las corrientes de entrada y salida por flechas y las operaciones o procesos como cajas rectangulares . En ellas tendrán lugar por ejemplo reacciones químicas o procesos de mezcla o separación con una o varias entradas y en general una o varias salidas a veces con distintas fases : líquida, sólida o gaseosa.
- Colocar en el diagrama los datos conocidos y desconocidos.
- Colocar en las cajas del diagrama las reacciones ajustadas y rendimientos de operación.
- Seleccionar una unidad sencilla para los cálculos.
- Inspeccionar el diagrama y leer de nuevo el enunciado.
- Desarrollar un balance de materias parcial o total: Para cada elemento químico o sustancia que no reacciona se puede establecer un balance que iguale la entrada a la salida. Para ello conviene empezar con las sustancias más fáciles, es decir, aquellas que estén en una sola fase o una corriente única o bien que no reaccionen como sucede con los componentes inertes.
- Resolución del sistema de ecuaciones.
- Comprobar que la solución es lógica y no hay errores: Mediante la realización de un balance global de materia se puede comprobar que las masas totales entrante y saliente son iguales.
- Los subsistemas pueden consistir en equipos, puntos de unión de tuberías y/o combinaciones de subsistemas.
- Se puede escribir balances de materia para los componentes de cada subsistema y para su flujo másico total, así como para los componentes del sistema global y el flujo másico total del sistema global.
- El número de ecuaciones independientes de un problema no puede incrementarse escribiendo balances globales además de los balances de componentes para cada subsistema, pero éstos pueden sustituirse por aquéllos.
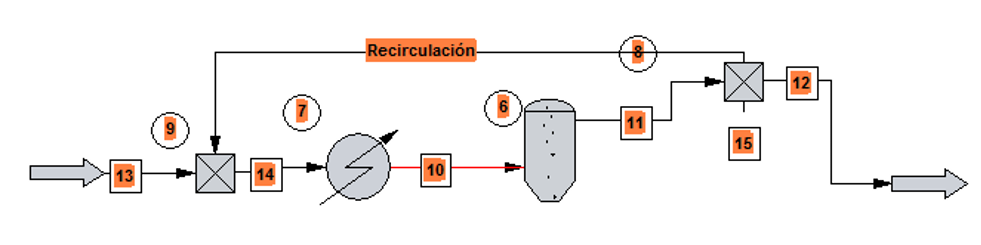
- En procesos de secado se controla la humedad recirculando parte del aire húmedo que sale del secadero.
- En reacciones químicas el material que no ha reaccionado se separa y se recircula al reactor.
- Las columnas de destilación con rectificación, recirculan parte del destilado.
- Realizado por:
- Francisco Aguilera
- Elizabeth González
- Arianna Lezama
Comentarios
Publicar un comentario