Equilibrio de Fases para Sistemas Binarios (Equilibrio S-L y L-L)
Solubilidad de Sólidos en líquidos
La capacidad de una sustancia para disolverse en otra se llama solubilidad. La variación de solubilidad está relacionada con el calor absorbido o desprendido durante el proceso de disolución. Si durante el proceso de disolución se absorbe calor la solubilidad crece con el aumento de la temperatura, y por el contrario, si se desprende calor durante el proceso de disolución, la solubilidad disminuye con la elevación de temperatura. La presión no afecta a la solubilidad en este caso.
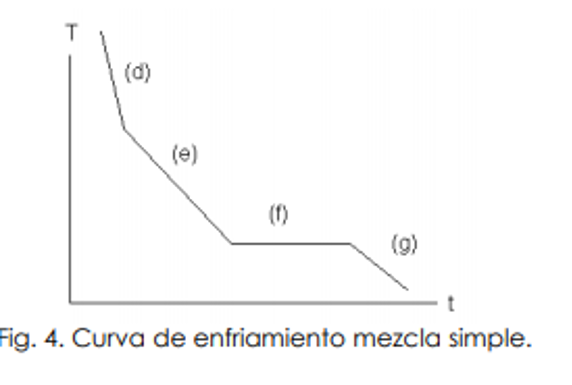
Curvas de enfriamiento
En la curva de enfriamiento de una mezcla simple, la solución líquida comienza a enfriarse, disminuyendo su temperatura a cierta velocidad (d). A una determinada temperatura comienza a separarse un sólido formado por alguno de los componentes puros. El congelamiento es un fenómeno exotérmico y por eso la velocidad de enfriamiento disminuye (e). A medida que el sólido se separa, la composición del líquido se hace más rica en el otro componente y su temperatura de fusión disminuye. Cuando la solución alcanza una cierta composición (la composición eutéctica) el sistema se congela como si se tratase de una sustancia pura y la temperatura se mantiene constante (f). Cuando todo el sistema se convierte en sólido, la temperatura vuelve a variar (g).
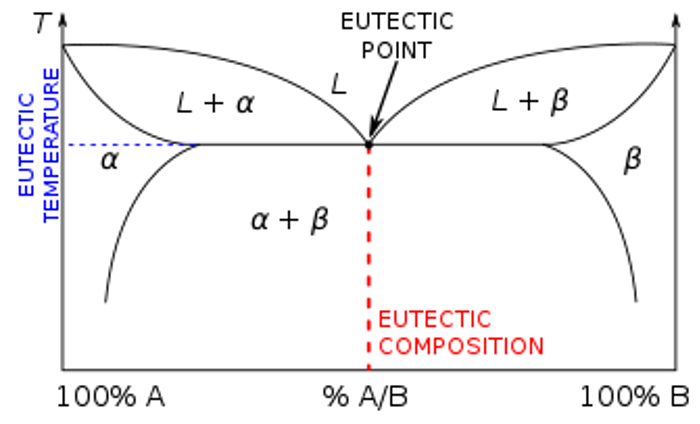
Diagramas de Fases. Sólidos inmiscibles-Líquidos miscibles. (Diagrama Eutéctico)
Los diagramas eutécticos son aquellos que se presentan cuando ambos componentes, en presencia uno del otro, comienzan a disminuir su punto de fusión. Sin embargo, este punto o temperatura de fusión no puede descender indefinidamente, tiene un punto máximo. Ese punto máximo se llama punto eutéctico y cuando aparece, se trata entonces de un diagrama eutéctico. Otra forma de describir al punto eutéctico, es como la temperatura mínima a la cual se puede fundir una mezcla de sólidos (generalmente, dos sólidos), los cuales poseen una composición fija.
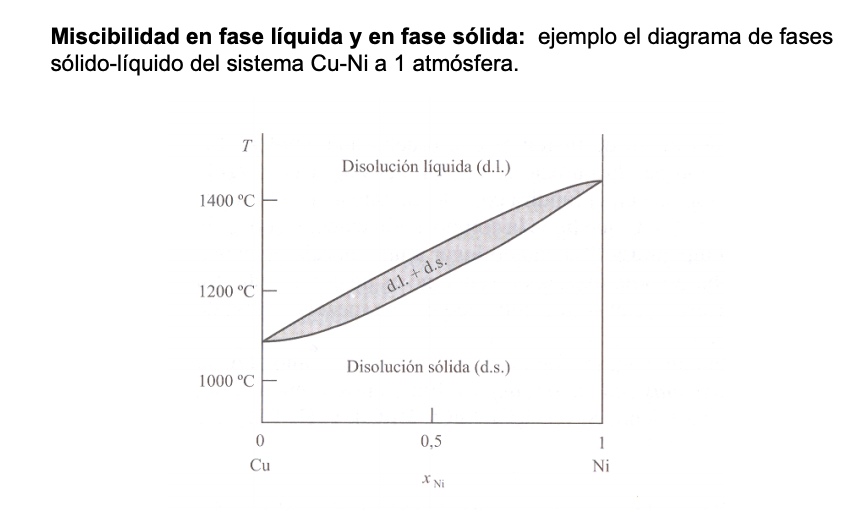
Diagramas de Fases. Sólidos y Líquidos miscibles
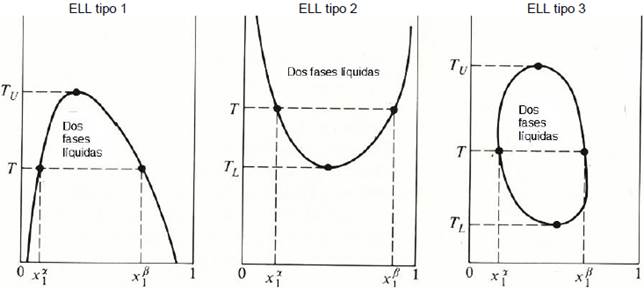
Sistema Binario. Equilibrio Líquido- Líquido
Cuando dos líquidos se mezclan en diferentes proporciones a ciertas condiciones de temperatura y presión, se producen dos fases líquidas de diferente concentración que están en equilibrio termodinámico, entonces se tiene el fenómeno de equilibrio Líquido-Líquido (ELL).
- Realizado por:
- Francisco Aguilera
- Elizabeth González
- Arianna Lezama

Comentarios
Publicar un comentario